Щелочь
Щелочь (синоним – алкали) - так называется любой из растворимых гидроксидов щелочных металлов, то есть лития, натрия, калия , рубидия и цезия. Щелочи являются сильными основаниями, они вступают в реакцию с кислотами с получением нейтральных солей. Они едкие и в концентрированном виде являются коррозионными веществами для органических тканей. Термин щелочь также применяется к растворимым гидроксидам таких щелочноземельных металлов, как кальций, стронций и барий, а также к гидроксиду аммония . Название вещества - щелочь , первоначально применялось к золе сожженных растений, содержащих натрий или калий, из которых можно было выщелачивать оксиды натрия или калия.
Среди всех производимых промышленностью щелочей наибольшая доля таких производств приходится на выработку кальцинированной соды (Na2CO3 -карбонат натрия ) и каустической соды (NaOH-гидроксид натрия ). Следующими по объему производства идут в списке щелочи гидроксид калия (KOH-едкий кали) и гидроксид магния (Mg(OH)2-магния гидрат).
Производство широкого спектра потребительских товаров зависит от использования щелочей на определенном этапе. Кальцинированная и каустическая соды имеют важное значение для производства стекла, мыла, вискозы, целлофана, бумаги, целлюлозы, моющих средств, текстиля, умягчителей воды, в производстве некоторых металлов ( в особенности алюминия), бикарбоната соды, бензина и многих других нефтепродуктов и химических веществ.
на определенном этапе. Кальцинированная и каустическая соды имеют важное значение для производства стекла, мыла, вискозы, целлофана, бумаги, целлюлозы, моющих средств, текстиля, умягчителей воды, в производстве некоторых металлов ( в особенности алюминия), бикарбоната соды, бензина и многих других нефтепродуктов и химических веществ.
Немного исторических моментов из истории получения щелочи.
Люди на протяжении столетий используют щелочь, получая ее сначала от выщелачивания (водных растворов) некоторых пустынных земель. До конца 18 века выщелачивание из древесной золы или морской водоросли было основным источником получения щелочей. В 1775 году Французская Академия наук предложила денежные призы за новые методы производства щелочей. Премия за кальцинированную соду была присуждена французу Николасу Леблану , который в 1791 году запатентовал процесс превращения хлорида натрия в карбонат натрия.
Лебланский способ производства доминировал в мировом производстве до конца 19-го века, но после первой мировой войны был полностью вытеснен другим методом конверсии соли, который был усовершенствован в 1860-х годах Эрнестом Солве из Бельгии. В конце XIX века появились электролитические методы производства каустической соды, объемы которых быстро росли.
По методу Солве, аммиачно-содовый процесс производства кальцинированной соды протекал следующим образом: поваренная соль в виде сильного рассола химически обрабатывалась для устранения примесей кальция и магния и затем насыщалась рециркулирующим газом аммиака в башнях. После, аммиачный рассол насыщался газом с использованием газообразного диоксида углерода при умеренном давлении в башне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которого дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают до разложения его до необходимого карбоната натрия. Аммиак, вовлеченный в процесс, почти полностью восстанавливается путем обработки хлоридом аммония с известью, с получением аммиака и хлорида кальция. Восстановленный аммиак затем повторно используют в описанных выше процессах.

Электролитическое производство каустической соды включает электролиз сильного солевого раствора в электролитической ячейке . (Электролиз - это разрушение соединения в растворе в его составляющие с помощью электрического тока для того, чтобы вызвать химическое изменение.) Электролиз хлорида натрия дает хлор, гидроксид натрия, либо металлический натрий. Гидроксид натрия в некоторых случаях конкурирует с карбонатом натрия в одних и тех же процессах применений. И в любом случае оба являются взаимопревращаемыми с помощью довольно не сложных процессов. Хлорид натрия может быть

превращен в щелочь одним из двух процессов, причем разница между ними заключается лишь в том, что процесс аммиачно-содовой реакции дает хлор в виде хлорида кальция, соединения с небольшим экономическим значением, тогда как электролитические процессы производят элементарный хлор , который имеет бесчисленное применение в химической промышленности.
В нескольких местах в мире существуют значительные запасы минеральной формы кальцинированной соды, известной как природная щелочь. На таких месторождениях производят большую часть природной щелочи в мире из обширных месторождений в подземных шахтах.

Природный натрий металлический.
Прочитайте статью Щелочи (источник "Энциклопедический словарь химика")и получите больше представления о том что такое щелочь, или посмотрите видеоролик об этом химическом реактиве Щелочи.
Использование щелочи в окружающей нас среде
Щелочь снискала широкое применение в нашей жизни. Благодаря щелочи можно в той или иной форме добиться смягчения воды и удалить из нее примеси, такие как марганец, фториды и органические танины. В тяжелых отраслях промышленности используют щелочь в виде извести для поглощения и нейтрализации оксидов серы в выбросах в атмосферу, тем самым уменьшая вероятность выпадения кислотных осадков. Диоксид серы, производимый промышленными предприятиями и выпускаемый в атмосферу, возвращается на землю в виде кислотных дождей или серной кислоты. Такие территории, подвергшихся воздействию кислотных дождей, обрабатываются с помощью авиации препаратами, в состав которых входит щелочь. Это позволяет контролировать и нейтрализовывать критический уровень рН воды и почвы на участках, где произошли такие техногенные выбросы. Внесение щелочи в отходы и сточные воды, поддерживая правильный уровень рН в окислительных процессах при их разложении. Стабилизирует образования осадка в сточных водах и уменьшает запах или образования патогенных бактерий. Обработанный негашеной известью ил из сточных водоемов, соответствует экологическим нормам, что делает его пригодным в дальнейшем в использовании в качестве удобрения на сельскохозяйственных землях.
Промышленное применение щелочи
В промышленных и горных работах применение щелочей в сточных водах помогает нейтрализовать вредные соединения и произвести их очистку. Обработка избыточной щелочью, повышает рН воды до 10,5-11 и может дезинфицировать воду и удалять тяжелые металлы. Щелочи, такие как известь, являются ключевыми в химическом производстве карбида кальция, лимонной кислоты, нефтехимии и магнезии. В бумажной промышленности карбонат кальция является каустифицирующим агентом для отбеливания. Сталелитейная промышленность зависит от извести в качестве компонента для удаления примесей, таких как газообразный монооксид углерода, кремния, марганца и фосфора.
Моющие средства образованные щелочью
Щелочные моющие средства помогают при очистке поверхностей с сильными загрязнениями. Эти экономичные, водорастворимые щелочи с рН от 9 до 12,5 могут нейтрализовать кислоты в различных типах грязи и отложениях.
Щелочь в производстве стекла и керамики
Щелочь является основным сырьем в производстве стекла. Известняк, а также песок, кальцинированная сода, известь и другие химикаты, обжигаются при чрезвычайно высоких температурах и превращаются в расплавленную массу. Стеклодувы и гончары используют щелочи для глазурей и флюсов, которые реагируют с кислотами с образованием силикатов (стекла) при нагревании. Концентрированные щелочи создают более насыщенный цвет в глазури.
Литература о щелочи
В книге И. Нечаева "Рассказы об элементах", изданной в 1940 году, доступным и понятным языком для обывателя рассказывается о том, что такое щелочь и чем она отличается от другого едкого вещества - кислоты. Выдержка из текста:
рассказывается о том, что такое щелочь и чем она отличается от другого едкого вещества - кислоты. Выдержка из текста:
"Среди многочисленных веществ, которыми химики с давних времен пользовались в своих лабораториях, почетное место всегда занимали едкие щелочи — едкое кали и едкий натр. Сотни различных химических реакций осуществляются в лабораториях, на заводах и в быту при участии щелочей. С помощью едких кали и натра можно, например, сделать растворимыми большинство нерастворимых веществ, а самые сильные кислоты и удушливые пары можно благодаря щелочам лишить всей их жгучести и ядовитости.
Едкие щелочи — очень своеобразные вещества. На вид это беловатые, довольно твердые камни, ничем как будто не примечательные. Но попробуйте взять едкое кали или натр и зажать его в руке. Вы почувствуете легкое жжение, почти как от прикосновения к крапиве. Долго держать в руке едкие щелочи было бы нестерпимо больно: они могут разъесть кожу и мясо до кости. Вот почему их называют «едкими», в отличие от других, менее «злых» щелочей — всем известных соды и поташа. Из соды и поташа, кстати сказать, почти всегда и по лучались едкие натр и кали.
У едких щелочей сильнейшее влечение к воде. Оставьте кусок совершенно сухого едкого кали или натра на воздухе. Через короткое время на его поверхности неизвестно откуда появится жидкость, потом он весь станет мокрым и рыхлым и под конец расползется бесформенной массой, как кисель. Это из воздуха щелочь притягивает к себе пары воды и образует с влагой густой раствор. Кому впервые приходится погрузить пальцы в раствор едкой щелочи, тот с удивлением заявляет: — Как мыло! И это совершенно правильно. Щелочь — скользкая, как мыло. Больше того: мыло потому и «мыльно» на ощупь, что его изготовляют с помощью щелочей. Раствор едкой щелочи и на вкус напоминает мыло.
Но химик узнаёт едкую щелочь не по вкусу, а по тому, как это вещество ведет себя с краской лакмус и с кислотами. Бумажка, про питанная синей краской лакмус, мгновенно краснеет, когда ее опус кают в кислоту; а если этой покрасневшей бумажкой дотронуться до щелочи, то она тотчас же опять становится синей. Едкая щелочь и кислота не могут мирно существовать рядом ни одной секунды. Они тотчас же вступают в бурную реакцию, шипя и разогреваясь, и уничтожают друг друга до тех пор, пока в растворе не останется ни крупинки щелочи или ни капли кислоты. Только тогда наступает успо коение. Щелочь и кислота «нейтрализовали» друг друга, говорят в таких случаях. От соединения их между собой получается «нейтральная» соль — ни кислая, ни едкая. Так, например, от соединения жгучей соляной кислоты с едким натром получается обыкновеннейшая поваренная соль."
Отличительные признаки щелочи.
Из выше прочитанного мы уже знаем, что противоположностью щелочи является кислота. Вместо горького вкуса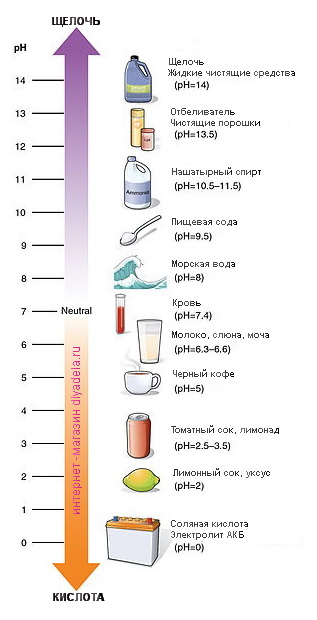 присущего щелочи, кислоты, как правило, имеют кислый вкус. Примером могут служить пищевые продукты, такие как: лимоны или фруктовый уксус (разбавленный), посути являющимися кислотными продуктами и обладающими в составе кислотой. Мы можем определить, является ли вещество щелочью или кислотой, зная ее рН. Уровень рН измеряется с помощью шкалы рН ; эта шкала колеблется от 0-14, и эти цифры показывают нам, является ли вещество щелочью или кислотой. Чистая дистиллированная вода имеет уровень pH 7 и называется нейтральным веществом (находится прямо посредине шкалы). Любое вещество, которое имеет рН выше 7, представляет собой щелочное вещество, которое также может называться щелочью. И, любое другое вещество, которое имеет рН ниже 7, представляет собой кислоту.
присущего щелочи, кислоты, как правило, имеют кислый вкус. Примером могут служить пищевые продукты, такие как: лимоны или фруктовый уксус (разбавленный), посути являющимися кислотными продуктами и обладающими в составе кислотой. Мы можем определить, является ли вещество щелочью или кислотой, зная ее рН. Уровень рН измеряется с помощью шкалы рН ; эта шкала колеблется от 0-14, и эти цифры показывают нам, является ли вещество щелочью или кислотой. Чистая дистиллированная вода имеет уровень pH 7 и называется нейтральным веществом (находится прямо посредине шкалы). Любое вещество, которое имеет рН выше 7, представляет собой щелочное вещество, которое также может называться щелочью. И, любое другое вещество, которое имеет рН ниже 7, представляет собой кислоту.
Почему вещество щелочное?
Таким образом, нам уже известно, что рН уровень представляет собой шкалу, значения которой колеблятся от 0-14 и указывают, является ли вещество щелочью или кислотой. Однако мы действительно не знаем, почему. Давайте рассмотрим этот вопрос более детально.
Уровень рH вещества зависит от того, как атомы расположены и объединены в веществе. Чистая вода находится прямо в середине шкалы и имеет pH 7. Это означает, что она содержит равное количество атомов водорода (H +) и гидроксидных атомов (OH-). Когда вещество имеет больше атомов водорода (Н +), это кислота. Когда вещество имеет больше гидроксидных атомов (OH-), оно является щелочным.
Где купить щелочь?
Купить щелочь в Новосибирске со степенью очистки ЧДА (чистая для анализов) в магазине "Для дела" можно на странице заказов: едкий натр NaOH или едкий кали KOH. Для иногородних покупателей товар может быть отправлен Почтой РФ или транспортными компаниями.
Авторские права
Права на данную статью принадлежат администратору сайта dlyadela.ru : Фарафонову Константину Владимировичу. Для подтверждения авторских прав была произведена процедура депонирования материалов опубликованного контента. Любое копирования материалов этой статьи не допускается, без письменного согласия правообладателя. Оценочная стоимость контета страницы https://dlyadela.ru/page/scheloch установлена в размере 100 долларов США.
Лицо, несанкционированно осуществившее частичное или полное копирование представленных на странице материалов и разместившее их в последствие на сторонних интернет-ресурсах, выражает свое согласие выплатить правообладателю пятикратную оценочную стоимость украденного контента.
Если вы желаете использовать материалы нашего сайта, пожалуйста, свяжитесь с нами.
